Contenu de l'article
TogglePourquoi la nutrition reste une vraie solution contrairement aux traitements médicamenteux de l’obésité ?
L’obésité est aujourd’hui reconnue comme une maladie chronique multifactorielle, impliquant des dimensions biologiques, psychologiques, sociales et environnementales. Face à cette complexité, la médecine a développé ces dernières années de nouveaux traitements pharmacologiques (traitements médicamenteux de l’obésité) visant à induire une perte de poids significative. Des médicaments anciens comme l’orlistat (Xenical, Alli), le bupropion-naltrexone (Contrave, Mysimba), la phentermine-topiramate (Qsymia, Adipex-P, Lomaira), ou encore des thérapies plus ciblées comme le setmélanotide (Imcivree) ont été rejoints par les analogues du GLP-1 comme le liraglutide (Saxenda, Victoza), le sémaglutide (Ozempic, Wegovy, Rybelsus) ou le tirzépatide (Mounjaro, Zepbound), qui deviennent des traitements emblématiques.
Ces nouveaux médicaments suscitent un grand espoir : dans les essais cliniques, la perte de poids peut atteindre 10 à 20 % du poids initial en un an, parfois davantage.
Mais une question essentielle demeure : que se passe-t-il lorsque le patient arrête son traitement ?
Objectif de l’article sur les traitements médicamenteux de l’obésité
Cet article examine de manière scientifique la réalité de la reprise pondérale après l’arrêt de ces traitements, afin d’apporter un éclairage utile aux professionnels de santé. L’objectif est de souligner que si les traitements médicamenteux de l’obésité peuvent constituer une aide ponctuelle, seule une prise en charge nutritionnelle et comportementale durable permet de traiter l’obésité dans sa complexité et de prévenir les rechutes.
Les traitements plus anciens : efficacité modeste et regain quasi systématique
Orlistat (Xenical, Alli)
L’orlistat agit par inhibition de la lipase intestinale qui participe à la digestion des graisses alimentaires. en réduisant leur absorption. La perte de poids obtenue est modeste (2 à 5 % du poids initial).
À l’arrêt du traitement, les patients reprennent généralement l’ensemble du poids perdu en quelques mois, ce qui témoigne de l’absence d’effet durable sur les comportements alimentaires et les déterminants de la prise de poids.
Bupropion-naltrexone (Contrave, Mysimba)
Cette association vise à moduler la récompense alimentaire et la satiété. Les résultats montrent une perte de 5 à 9 % du poids initial après un an.
Toutefois, comme pour les agonistes du GLP-1, l’arrêt du traitement conduit à une reprise quasi complète du poids perdu, en particulier au cours de la première année post-traitement.
Phentermine-topiramate (Qsymia, Adipex-P, Lomaira)
Malgré des résultats initiaux intéressants (jusqu’à 10 % du poids corporel perdu), l’usage prolongé est limité par les effets secondaires cardiovasculaires et psychiatriques.
L’arrêt entraîne une reprise rapide, parfois même supérieure au poids de départ, traduisant un effet rebond marqué.
Setmélanotide (Imcivree)
Indiqué dans des formes très rares d’obésité d’origine génétique (déficits des récepteurs de la mélanocortine), le setmélanotide peut induire une perte de poids significative et durable, mais uniquement tant que le traitement est poursuivi.
Là encore, l’arrêt se traduit par une reprise quasi systématique du poids, faute de modification structurelle des comportements alimentaires.
Les nouveaux traitements : analogues du GLP-1 et agonistes du GIP
L’hormone GPL-1
Le GLP-1 (pour glucagon-like peptide-1) est un peptide naturel produit par les cellules L endocrines de l’intestin, situées dans l’iléon (dernière partie de l’intestin grêle) et le côlon. Il est sécrété en réponse à la prise d’aliments contenant des glucides ou des lipides. Son rôle principal est de réguler la glycémie et l’appétit, ce qui explique l’intérêt porté à cette hormone dans le traitement du diabète de type 2 et de l’obésité.
Le GLP-1 agit selon plusieurs mécanismes physiologiques.
Tout d’abord, il stimule la sécrétion d’insuline de manière glucose-dépendante, ce qui signifie qu’il augmente la libération d’insuline seulement quand la glycémie est élevée, réduisant ainsi le risque d’hypoglycémie. En parallèle, il inhibe la sécrétion de glucagon, une hormone qui élève la glycémie, ce qui contribue à un meilleur contrôle du métabolisme du glucose.

Sur le plan digestif, le GLP-1 ralentit la vidange gastrique, prolongeant ainsi la sensation de satiété. Au niveau du système nerveux central, il agit sur les centres hypothalamiques de la régulation de l’appétit, entraînant une réduction de la prise alimentaire.
Toutefois, le GLP-1 naturel a une durée de vie très courte dans l’organisme (quelques minutes seulement), car il est rapidement dégradé. Des analogues du GLP-1 ont donc été développés et brevetés : ils reproduisent ses effets mais avec une action prolongée.
En résumé, le GLP-1 est une hormone clé à l’interface entre l’intestin, le pancréas et le cerveau. Son rôle dans la régulation de la glycémie et de l’appétit en fait une cible thérapeutique majeure, mais son action naturelle montre aussi à quel point nutrition et signaux hormonaux intestinaux sont intimement liés.
L’hormone GIP
Le GIP (glucose-dependent insulinotropic polypeptide) est, lui, un peptide de 42 acides aminés produit par les cellules K du duodénum (première partie de l’intestin grêle). Il est sécrété en réponse à la présence de glucose et d’acides gras. Lui aussi a un effet régulateur sur l’appétit. Mais ses mécanismes d’action chez l’homme sont encore peu compris.
Les agonistes du GLP-1 et du GIP : des résultats spectaculaires mais transitoires
Pour luter contre l’obésité, l’astuce des laboratoires consiste à leurrer notre physiologie : des agonistes (molécules ayant des effets similaires) du GLP-1 et du GIP ont été imaginés, testés, développés et enfin commercialisés.
Ces nouveaux traitements sont très onéreux (environ 300 euros/mois pendant 6 mois à 2 ans), et ce d’autant plus qu’ils ne sont pas remboursés, sauf depuis le 1er février 2025 et dans un cadre restreint et bien précis.
Ils ont également la contrainte d’être, pour l’instant, des médicaments injectables seulement, avec une auto administration sous-cutanée.
Liraglutide (Victoza, Saxenda)
Le liraglutide, utilisé initialement dans le diabète de type 2 puis repositionné à des doses plus élevées pour l’obésité, a permis une perte de poids moyenne de 5 à 8 % du poids corporel : 8.5 kg en moyenne en 56 semaines de traitement. Dans l’essai SCALE, les patients traités par Saxenda ont maintenu une perte significative tant que le traitement était poursuivi.
Mais lors de l’arrêt, une reprise rapide s’est produite : la majorité des participants regagnaient environ deux tiers du poids perdu en l’espace d’un an. Cette dynamique illustre la dépendance directe entre la pharmacologie et l’effet observé.
Sémaglutide (Ozempic, Wegovy, Rybelsus)
Le sémaglutide a suscité un engouement mondial, en partie à cause de résultats impressionnants, avec une perte pouvant dépasser 15 % du poids initial dans les études STEP.
Ainsi, l’étude SELECT, avec un traitement pendant 4 ans, a montré une perte de poids moyenne de 17 kg en 18 mois environ de traitement, avec une stagnation au-delà.
A l’arrêt du traitement, les données STEP-4 sont édifiantes : après 20 semaines de traitement et une perte de poids moyenne de 11.3 kg (10.6% du poids), l’arrêt du sémaglutide a conduit à une reprise moyenne de 58 % du poids perdu un an après l’arrêt du traitement (6.6 kg en moyenne). Après 68 semaines de traitement, l’arrêt du sémaglutide a conduit à une reprise moyenne de deux tiers du poids perdu en un an environ
Tirzépatide (Mounjaro, Zepbound)
Plus récent, le tirzépatide combine une action sur les récepteurs du GLP-1 et du GIP. Les résultats de l’essai SURMOUNT-1 ont montré une perte de poids encore supérieure à celle obtenue avec le sémaglutide.
Cependant, les données préliminaires sur l’arrêt du traitement confirment une tendance analogue : l’effet bénéfique s’efface progressivement dès que la molécule est retirée, avec une reprise de poids significative dans les 12 mois suivants, et ce sans stabilisation observée.
Ainsi, après un traitement de 36 semaines, les patients ont en moyenne regagné la moitié du poids perdu, avec un effet particulièrement marqué durant les 12 semaines qui ont suivi l’arrêt du traitement. Cet effet de reprise de poids semble encore plus marqué avec le tirzépatide.
Ces observations suggèrent que les agonistes des incrétines ne modifient pas les déterminants profonds de l’obésité : ils agissent essentiellement comme un frein pharmacologique momentané et réversible sur l’appétit.
Ainsi, les bénéfices obtenus sont largement conditionnés à la continuité du traitement, posant la question de la soutenabilité économique et médicale d’une prescription chronique à vie.
Données globales
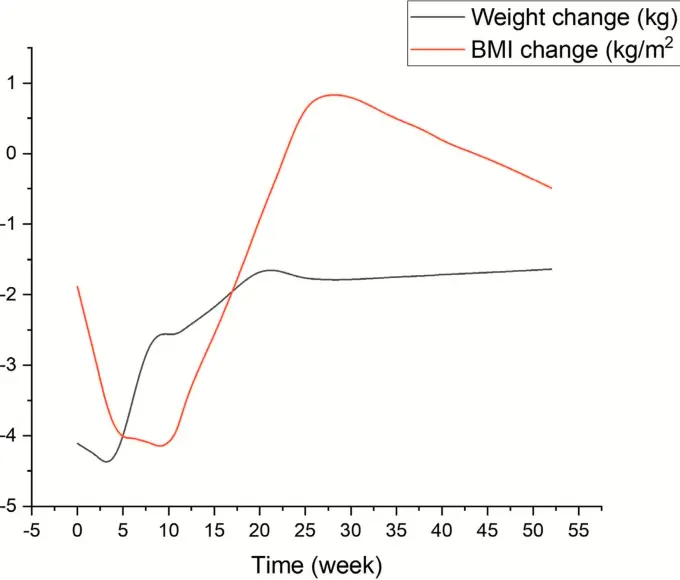
Une méta-analyse regroupant onze essais cliniques randomisés avec différents traitements parmi ceux cités plus haut montre que tous ces médicaments sont associés à une reprise de poids à partir de la huitième semaine suivant l’arrêt du traitement. Ce regain de poids généralisé après la fin du traitement, se poursuit jusqu’à environ la 20ème semaine, avant de se stabiliser progressivement avec un semblant de stagnation observé vers la 52ᵉ semaine (soit 1 an environ). On manque de données sur des durées plus longues.
La courbe ci-dessous montre les évolutions moyennes du poids en écart par rapport au poids initial en fonction du temps après l’arrêt du traitement (T=0), avec l’évolution de l’IMC (BMI en anglais). Source : « trustmyscience » : 1 574 participants traités et 893 patients témoins ont été analysés et suivis.
Une perte de poids moyenne de 4 kg en moyenne a été observée à l’aide du traitement. La reprise de poids se fait d’abord rapidement, puis continue plus lentement, mais sûrement.
La reprise de poids : une réalité physiologique et comportementale
La tendance à reprendre du poids après arrêt d’un traitement médicamenteux repose sur plusieurs mécanismes :
- Physiologiques : la baisse du poids corporel entraîne une diminution de la dépense énergétique au repos et une augmentation des signaux orexigènes (susceptibles d’augmenter l’appétit) comme la ghréline, favorisant la faim. Les médicaments neutralisent partiellement ces mécanismes, mais dès qu’ils disparaissent, la physiologie reprend ses droits.
- Sociaux et environnementaux : l’environnement alimentaire trop industriel, associé au stress et à la sédentarité, exerce une pression constante, difficile à surmonter sans une réorganisation durable du mode de vie ni sans soutien par un professionnel compétent en matière de comportements alimentaires.
- Comportementaux : la prise d’un médicament peut induire une dépendance psychologique vis-à-vis d’un « outil externe », ne nécessitant pas de modification des habitudes alimentaires ou du rapport au corps. Changer ses habitudes alimentaires est une démarche universellement perçue comme pénible : pourquoi s’y contraindre si la perte de poids se fait toute seule ? Les conseils diététiques classiques de restriction qui accompagnent pourtant la prescription de ces nouveaux traitements sont, comme pour tout le monde, difficiles à suivre sur le long terme. Leur mise en place ne peut donc être que transitoire elle aussi, et s’arrêter à la fin du traitement, au moment où la perte de poids semble être acquise. L’arrêt du traitement et celui, progressif, des mesures diététiques classiques d’accompagnement, conduisent donc très souvent à un retour aux comportements antérieurs.
Conséquence : Les mêmes causes produisent les mêmes effets. Sans modification durable et adéquate des habitudes alimentaires, aucune perte de poids ne peut être pérenne : si elle ne s’accompagne pas d’une prise de conscience essentielle et de l’acquisition d’un minimum de connaissances sur les liens entre les choix alimentaires qui sont faits au quotidien et le poids, la reprise de poids est inéluctable. Et elle est même parfois supérieure au poids perdu avec l’aide du traitement.
Pourquoi la nutrition et l’accompagnement comportemental sont plus durables que les traitements médicamenteux de l’obésité
Contrairement aux médicaments, les interventions nutritionnelles et comportementales visent à transformer les habitudes de vie, en agissant directement sur les causes de l’obésité. Les programmes qui associent rééducation alimentaire, activité physique adaptée et soutien psychologique montrent des résultats plus modestes à court terme, mais plus stables à long terme.
Les méta-analyses indiquent qu’une perte de 5 à 10 % du poids corporel obtenue avec des « régimes » classiques peut être maintenue plusieurs années lorsque les patients sont accompagnés dans la durée. Surtout, ces approches réduisent les comorbidités métaboliques (diabète de type 2, hypertension, maladies cardiovasculaires) indépendamment de l’ampleur de la perte de poids.
Ceci est sans préjuger d’une approche plus physiologique que la simple restriction (cf article sur l’absurdité des régimes hypocaloriques) qui conduit à des résultats plus importants, durables, et de manière beaucoup plus confortable.
En d’autres termes, la nutrition ne se contente pas de « forcer » la perte de poids : elle reconstruit un équilibre métabolique et comportemental durable, ce qu’aucun médicament n’a réussi à accomplir à ce jour.
Par ailleurs, un point essentiel concerne la perte de poids qui n’est jamais détaillée dans les études publiées : que perd on, eau, masse grasse, masse maigre ?
Cibler la masse grasse doit être l’effet exclusif visé de toute perte de poids. A cet égard, l’approche restrictive classique ne permet pas de générer une perte de poids en toute sécurité, tout comme l’approche médicamenteuse.
Conclusion sur les traitements médicamenteux de l’obésité
Les nouveaux médicaments anti-obésité comme le liraglutide, le sémaglutide ou le tirzépatide représentent indéniablement un progrès pharmacologique. Ils permettent d’obtenir des pertes de poids rapides et significatives, utiles notamment dans des situations cliniques urgentes, mais qui semblent stagner au-delà d’un an de traitement.
De plus, ils ne restent efficaces que tant qu’ils sont pris. Car leurs bénéfices sont largement transitoires : à l’arrêt du traitement, la majorité des patients regagnent en quelques mois une part importante, voire la totalité, du poids perdu.
Ce constat interroge sur la pertinence d’un modèle reposant sur des traitements à vie, coûteux et non exempts d’effets secondaires. Ceux-ci sont encore inconnus sur le long terme.
À l’inverse, les solutions nutritionnelles et comportementales offrent une alternative plus lente mais solide, capable de modifier les habitudes alimentaires, de réduire les risques métaboliques et d’instaurer un changement durable.
Ainsi, pour les professionnels de santé — médecins, infirmiers, diététiciens, kinésithérapeutes et autres acteurs de la prise en charge — il est essentiel de promouvoir en priorité l’éducation nutritionnelle, l’accompagnement psychologique et l’activité physique, et de réserver les médicaments à des indications spécifiques, et surtout comme solutions temporaires.
Le véritable traitement de l’obésité ne réside pas dans une molécule, mais dans une méthode adéquate d’apprentissage et de mise en autonomie nutritionnels des patients qui apprendront ainsi à respecter leur corps et lui apporter exactement ce dont il a besoin.
Quelques articles sur ce sujet qui montrent que la nutrition est bien la grande exclue des laboratoires pharmaceutiques :


